AP化学必考点 - Equilibrium
Chemical equilibrium 是AP化学的重点和难点,这部分的知识点较多,包括最基本的平衡常数,LeChâtelier’s principle 和酸碱平衡,缓冲溶液,滴定平衡,溶解平衡的相关计算。
关于酸碱平衡,我们在后面的课程中会有专门的介绍,这次课主要总结平衡体系的一般特征,例如 equilibrium constant 和有关 Le Châtelier’s principle 需要掌握的内容。
Chemical equilibrium 是当一个 reversible reaction 的两个相反方向反应的速率相等时所建立的一个动态平衡(dynamic equilibrium)体系。
反应系数Q(reaction quotient )和反应平衡常数K(equilibrium constant)是用于衡量平衡反应的重要参数,其定义如下:
对反应:
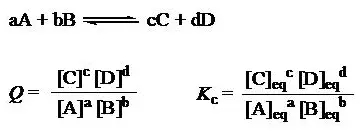
反应系数Q中的反应物和产物的浓度对应的是在反应进行到任意时刻的浓度;反应平衡常数K中的反应物和产物的浓度对应的是在反应达到平衡时的浓度。


有关 LeChâtelier’s Principle 的应用主要体现在反应浓度、压力和温度的改变对反应方向的影响。
浓度:反应物浓度增加或产物浓度降低,反应向生成产物方向进行;反应物浓度降低或产物浓度增加,反应向形成反应物方向进行。
压力(只对有气体参加的反应重要):增加压力或减小体积,反应向气体摩尔总数较少的一方进行;减小压力或增加体积,反应向气体摩尔总数较多的一方进行。
温度:增高温度,反应向吸热(endothermic)方向进行;降低温度,反应向放热(exothermic)方向进行。
需要注意:浓度和压力的改变并不改变反应平衡常数的大小,但温度的改变会使平衡常数改变。温度升高会使吸热反应的平衡常数增大,使放热反应的平衡常数减小。
溶解平衡(solubility equilibrium)是难溶于水的固体盐与其溶于水后产生的 cation 和 anion 之间建立起的一种平衡体系。因为反应物是固体,浓度可以认为是常数,所以这种平衡的 equilibrium constant(用Ksp表示)中只写出产物。
Common ion effect 是 Le Châtelier’s Principle 在 solubility equilibrium 中的应用。当在 solubility equilibrium 体系中添加一种与其相同的 cation 或 anion 时,平衡会向生产沉淀的方向移动,是盐的 solubility 降低。
新航道上海AP课程培训 中心,是新航道集团和美国Kaplan教育集团共建设,美国大学理事会在中国授权的AP嵌入式课程学习中心,AP Code:694387。