A-Level化学知识点:buffer solution缓冲溶液【干货】
今天给大家梳理一下A-Level/IB/AP化学中的一个重要知识点:buffer solution,缓冲溶液。
化学实验很多都需要在水溶液环境中进行,并且会需要一个pH较为稳定的水溶液环境。而在大部分溶液中,当加入强酸或强碱时,即使加入的体积很小,也会引起pH的剧变,进而影响实验效果。因此我们需要配置一个pH可以维持相对稳定的溶液,在加入少量强酸或强碱时也不会引起pH急剧变化,这就是缓冲溶液。
1►缓冲溶液(buffer solution)的定义和成分
就像上面说的,缓冲溶液(buffer solution)指的就是当少量强酸或强碱加入溶液中时,能够将pH变化最小化,使溶液pH变化相对恒定,“几乎”不变的溶液。
缓冲溶液一般由弱酸及其共轭碱(weak acid and its conjugate base),和弱碱及其共轭酸(weak base and its conjugate acid)混合组成。
举个例子,醋酸(CH3COOH)和醋酸钠(CH3COONa)的混合溶液就是一种缓冲溶液。在这个混合溶液中,弱酸是一种弱电解质,部分电离,而醋酸钠是一种强电解质,也就是发生完全电离。电离反应式如下:
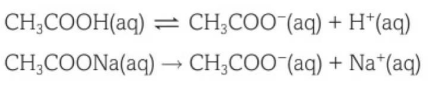
醋酸和醋酸钠的混合溶液pH低于7,具体pH需要根据醋酸和醋酸钠分别的浓度,和两种溶液的体积进行具体计算。
2►缓冲溶液(buffer solution)的pH计算
我们来计算一下刚才讲的例子,醋酸和醋酸钠的pH计算。
假设我们将以下醋酸(CH3COOH)和醋酸钠(CH3COONa)混合:
CH3COOH 1 mol dm-3 50mL
CH3COONa 1 mol dm-3 50mL
首先分析醋酸(CH3COOH),由于醋酸是一种弱酸,只发生部分解离(partially dissociation),且弱酸电离常数Ka=1.74*10-5 mol dm-3,由Ka对应的计算公式可以得知,醋酸(CH3COOH)是一种解离程度很低的弱酸,为了便于计算,我们忽略醋酸(CH3COOH)的解离,近似认为醋酸不发生解离。
再来分析醋酸钠(CH3COONa),醋酸钠(CH3COONa)是一种可溶性盐,可溶性盐都是强电解质,也就是溶于水的部分会发生完全电离(completely ionised),即醋酸钠(CH3COONa)完全电离为醋酸根离子(CH3COO-)和钠离子(Na+)。
当醋酸(CH3COOH)和醋酸钠(CH3COONa)混合后,由于总溶液体积变为100mL,相当于原来每种溶液浓度的2倍,而这两种溶液中溶质的摩尔数都没有变,根据c=n/V可以算出,混合溶液中醋酸(CH3COOH)和醋酸钠(CH3COONa)的浓度都变为原来的1/2,即0.5 mol dm-3。

接下来再将这些数据代入Ka进行计算。
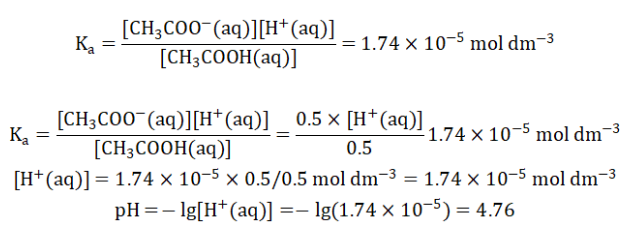
也就是说,浓度分别为1 mol dm-3 ,体积为50mL的醋酸(CH3COOH)和醋酸钠(CH3COONa)溶液的混合溶液pH为4.76。
我们再将这一算法推广到所有由弱酸及其共轭碱组成的缓冲溶液。
对于一种弱酸HA,其浓度一般被表示为[HA(aq)],它对应的共轭碱为A-,浓度表示为[A-(aq)],弱酸解离常数表示为Ka。
同样,我们认为HA这种弱酸几乎不发生解离,A-对应的盐完全解离,那么,Ka的式子可以表示为:
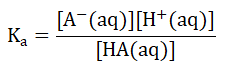
我们把[H+(aq)]提出来,将式子变为

这个公式被称为Henderson-Hasselbalch公式,其中,[HA]为缓冲溶液中弱酸的浓度,[A-]为缓冲溶液中弱酸的共轭碱的浓度。
3►向缓冲溶液中加入酸碱后pH变化
现在我们来验证一下在向刚才计算出pH为4.76的缓冲溶液中分别加入10 mL 1 mol dm-3 HCl(aq),和10 mL 1 mol dm-3 NaOH给溶液pH会带来怎样的变化。
我们先来回顾一下刚才提到的醋酸/醋酸根离子缓冲溶液的浓度和体积。
CH3COOH 1 mol dm-3 50mL
CH3COONa 1 mol dm-3 50mL
由此可以算出
n(CH3COOH) = 1 x 0.05 = 0.05 mol
n(CH3COO-) = 1 x 0.05 = 0.05 mol
1. 向溶液中加入10 mL 1 mol dm-3 HCl(aq)
此时加入的n(HCl) = 1 x 0.01 = 0.01 mol
HCl会和缓冲溶液中的CH3COO-以1:1的摩尔比进行反应,并生成相同摩尔数的CH3COOH,即在加入HCl后
n(CH3COO-) = 0.05 - 0.01 = 0.04 mol
n(CH3COOH) = 0.05 + 0.01 = 0.06 mol
此时的pH可以直接用Henderson-Hasselbalch公式进行计算,由于醋酸的电离常数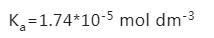
可以看出,pH变化是较小的,溶液pH在一个较为稳定的状态。
2. 向溶液中加入10 mL 1 mol dm-3 NaOH(aq)
此时加入的n(NaOH) = 1 x 0.01 = 0.01 mol
NaOH会和缓冲溶液中的CH3COOH以1:1的摩尔比进行反应,并生成相同摩尔数的CH3COO-,即在加入NaOH后
n(CH3COOH) = 0.05 - 0.01 = 0.04 mol
n(CH3COO-) = 0.05 + 0.01 = 0.06 mol
此时的pH可以直接用Henderson-Hasselbalch公式进行计算,由于醋酸的电离常数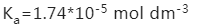
与加入HCl时一样,溶液pH变化较小在一个较为稳定的状态。
4►总结
缓冲溶液(buffer solution)的练习中比较容易出错的点是:
1. 将缓冲溶液当做弱酸进行计算,认为酸根离子和氢离子浓度一样
2. 在两种溶液混合后,忘记体积变化带来的每种溶质浓度变化。
缓冲溶液的题目涉及的计算量相对别的内容比较大,想要这部分不出错的话还是要多做历年真题多进行一些真题的计算练习。








