AP化学必考点-Electronic configuration解析
我们今天来说说AP化学课程。学理科的小伙伴们都非常喜欢的一门课,上海新航道AP课程培训中心也开设有AP化学这门课。具体,请:https://sh.xhd.cn/topic/AP/查看详情。
大家都知道Electronic configuration是AP考试的必考内容,用于表征原子核外 electron 的probability distribution and orientation,可以用四个 quantum number 进行描述。
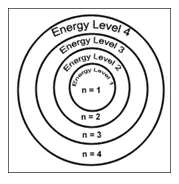
1. Principal quantum number
Principal quantum number, n,电子层或能级数, main energy level, or shell. 取值为正整数: n = 1, 2, 3, 4, . . .
2. Angular momentum quantum number
Angularmomentum quantum number, l, 电子亚层, sublevels or subshells
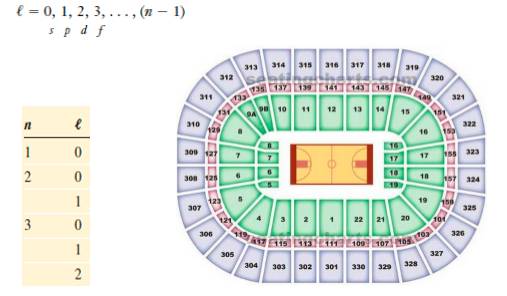
类似于NBA球场中的观众座位分为不同层(能级数, n), 每层(能级)内有不同排(电子亚层, l)的座位,不同电子亚层的能量是不同的,l 值越大代表其能量越高。
不同的l值对应的 orbital 形状也不同。
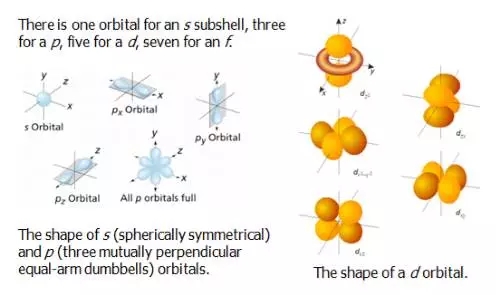
3. Magnetic quantum number
Magnetic quantum number, ml, 代表orbital在空间的不同伸展方向
ml的取值个数代表了orbital的多少。

4. Spin quantum number
Spin quantum number, ms, 代表电子的两种不同自旋方向产生与外界磁场相同或相反的磁场方向。ms = 1/2, -1/2

一个 orbitalal 由三个 quantum number(principle quantum number, angular momentum quantum number 和 magnetic quantum number)确定,但是一个 orbital 的能量只由 principle quantum number 和 angular momentum quantum number来决定。也就是说,具有相同n和l、不同magnetic quantum number 的 orbital,能量都相等,但 orientation 不同。
不同能级内的orbital示意图如下:
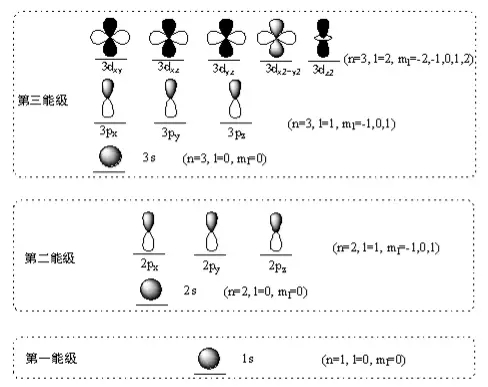
能级高低的示意图如下:
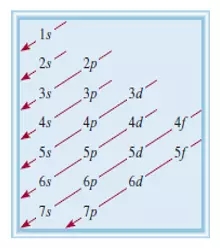
书写 electronic configuration 是,需要遵循 Aufbau Principle,也就是将electron 按照能级由低到高的顺序填入不同的 orbital 中,每个 orbital 最多容纳两个自旋相反的 electrons。
例如:
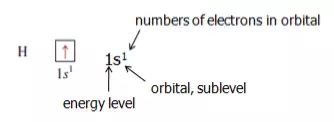
同时,在书写 electronic configuration 时,需要遵守Pauli Exclusion Principle 和 Hund’s Rule。
Pauli Exclusion Principle: No twoelectrons in an atom may have identical sets of four quantum numbers.
Hund’s Rule: Electronsoccupy all the orbitals of a given subshell singly before pairing begins. Theseunpaired electrons have parallel spins.
说了那么多,如果你需要AP化学课程培训,请:新航道上海AP课程培训。我们还有多种AP课程和多种AP班型,满足你的需求!









